小分子诱导的靶蛋白选择性降解是目前最有前途的新一代药物发现方法之一。以 PROTACs(PROteolysis-TArgeting Chimeras)为例,双功能小分子可以诱导靶蛋白连接到E3连接酶上,随后形成靶蛋白/PROTAC/连接酶三元复合物,促进细胞靶蛋白通过蛋白酶体降解(下图)。
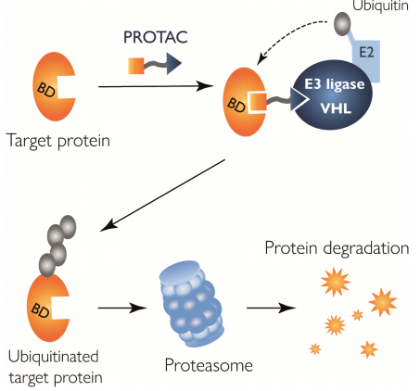
由于PROTAC的二价性质,三元复合物的形成从根本上说是一个多过程。PROTAC分子可以首先与目标蛋白质结合,如果与连接酶的亲和力较高,则连接酶结合后很可能会启动三元复合物的形成。如果PROTAC与一种蛋白质的结合因另一种蛋白质的存在而增强或减弱,要充分理解平衡,就必须将协同效应在内(下图)。在存在协同效应的情况下,相互作用不再是独立的--正协同是由于与中心分子结合的其中一种成分促进了三元复合物的形成,而负协同则意味着这种结合抑制了进一步的相互作用。
而下图中所呈现的曲线则展示了基于PROTAC的系统的另一个特点,三元复合物平衡呈现钟形剂量反应曲线。在这个系统中,增加PROTAC的总浓度会导致三元复合物浓度降低(也称为 "钩子效应"),大量过剩的PROTAC会使目标蛋白和连接酶各自达到饱和。如果 PROTAC 浓度设置得过高,在某些情况下可能会导致检测不到这些三元复合物。
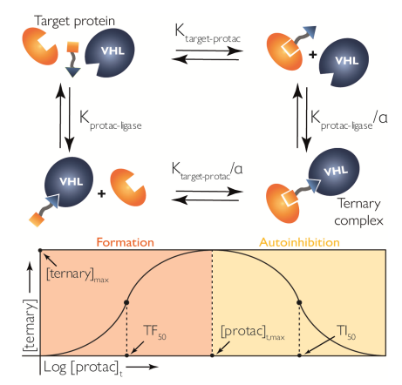
预测这种临界浓度和促进正协同效应以提高三元复合物的稳定性,被认为都是PROTAC诱导的三元复合物形成的有效方案。
与其他方法相比,质量光度法(MP)实验不需要对蛋白质进行标记或固定,可对溶液中的真实分子行为进行直接可视化和量化,因此可以对三元复合物形成的关键环节提供重要数据。
我们这次实验使用了一个经过充分研究的BRD4(包含两个溴结构域BD1和BD2)、VHL/ElonginC/ElonginB连接酶复合物和MZ1(PROTAC)系统。BRD4的失调与多种癌症的发病有关,基于PROTAC技术的BRD4降解器已成为一种新型疗法。
下图显示了质量分布随MZ1浓度增加而变化的情况。BRD4和实验中使用的 VHL/ElonginC/ElonginB连接酶复合物的分子量非常相似:VHL为 41.3 kDa,含有BD1和BD2 结构域的BRD4为 47.5 kDa。据报道,MZ1与VHL的亲和力为~100 nM,而BD1和BD2的溴化结构域都能与MZ1结合,对结构域的测量结果分别为 380 nM(BD1)和120 nM(BD2)。BRD4的浓度为 50 nM,而VHL/ElonginC/ElonginB连接酶复合物的浓度调整为100 nM。在实验中,三元复合物(所有BRD分子都参与)的完全形成将导致两个峰值,一个在50 kDa(剩余的VHL),一个在100 kDa(BRD4-MZ1- VHL复合物),检测到的事件数量大致相同。MZ1 浓度为1200 nM时,VHL和BRD4达到饱和状态,三元复合物的浓度骤降。
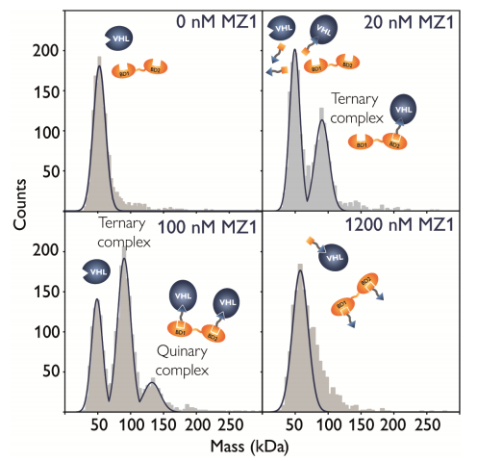
正如预期的那样,在没有PROTAC的情况下,检测到一个约50 kDa的单峰,表明BRD4和VHL之间没有蛋白-蛋白相互作用(VHL和BRD4之间的质量差无法分辨)。在 20 nM MZ1 时,就出现了第二个群体,对应于BRD4-MZ1-VHL复合物。50 kDa的峰值对应于游离的VHL 和BRD4,以及与PROTAC分子的复合物,由于质量差异较小,这些复合物无法分辨。将 MZ1 浓度提高到100 nM会进一步增加BRD4-MZ1-VHL三元复合物的比例,并导致 BRD4-MZ1₂-VHL₂二元复合物的形成。由于VHL的浓度是BRD4的两倍,因此 50 kDa 处的剩余峰值主要反映了游离连接酶的情况。当 PROTAC 浓度超过 1000 nM 时,观察到形成的三元复合物数量突然下降,这是二元相互作用取代三元复合物形成的结果。
综上所述,质量光度法可用于检测三元复合物的形成,并量化中间物种的相对浓度。重要的是,其结果是在溶液中获得的,在溶液中所有成分都存在并可自由相互作用,这与其他方法截然不同,后者只能将 "预形成 "的二元复合物与其中一种成分结合,以评估协同效应。此外,由于质量光度实验不需要标记或固定,并且可以在nM浓度下工作,因此大大节省了时间和材料,从而可以对生理相关蛋白质浓度下的相互作用进行详细表征。
RefeynTwoMP

测试蛋白/核酸/抗体等多种生物分子,分子量范围:30kDa-5MDa
SamuxMP

测试AAV 的空/实心比率等,分子量范围:500kDa-6MDa
同腾睿杰(上海)生物科技有限公司作为 Refeyn 中国代理商,为您提供优质的售前售后服务。
联系电话:021-50826962
联系邮箱:sales@ttbiotech.com




