在探索人体复杂的免疫系统时,我们经常与一类特殊细胞—中性粒细胞(Neutrophils)不期而遇。它们是血液中数量仅次于红细胞的细胞类型,占据了成人白细胞总数的40-70%[1]。中性粒细胞的主要免疫功能包括吞噬、脱颗粒和形成中性粒细胞胞外陷阱(NETs)。此外,它们还分泌几种调节炎症的细胞因子和趋化因子[2]。然而,中性粒细胞在体外研究中却充满了挑战,包括短至6-8小时的半衰期、对凋亡和激活的极度敏感性,以及难以扩增和冷冻保存的特性。用密度梯度等传统方法分离特定的中性粒细胞群体是具有挑战性的,因为这种方法会增加极化反应,导致中性粒细胞的人工激活[3,4]。
NanoCellect Biomedical, Inc. 推出的WOLF G2 单细胞柔性分选系统,以其温和、低激活的分选方式,确保了更好的存活率和纯度,使得中性粒细胞的研究和应用迈出了重要一步。
在室温条件下采集全血并于两小时内处理,通过双梯度离心法从全血中分离中性粒细胞。全血与缓冲液(HBSS、1% BSA以及2mM EDTA)1:1混合后,置于由Leuko Spin Medium和PBMC Spin Medium组成的双梯度中,经过1000 x g离心30分钟,收集粒细胞层。再通过缓冲液洗涤和1X RBC Lysis Buffer裂解红细胞,最后用分选缓冲液重悬细胞,使浓度达到1.0 x 10^7 cell/mL
用Human TruStain FcX和True-Stain Monocyte Blocker阻断非特异性结合,并在室温下抚育15分钟,随后用CD45 APC-Cy7、CD16 AF488、CD11b PE和SYTOX AADvanced对细胞进行染色。经37 µm滤帽过滤后,以3 x 105 cell/mL的浓度进行分析和分选。
感兴趣的细胞群体由CD16-AF488阳性和SYTOX AADvanced阴性的活中性粒细胞组成(图1)。将1 x 105个细胞分选到含有分选缓冲液的收集管中。此外,制备了一个样本并用细胞活化混合物(BioLegend,#423301)进行刺激,作为中性粒细胞活化的对照。而且,使用单染对照、SpectraComp 补偿微球(Slingshot Bio,#SSB-05-A)和 ViaComp 微球(Slingshot Bio,#SSBS-003)创建了一个补偿矩阵。使用WOLF G2软件进行细胞分选,通过一系列圈门策略,从单细胞门到存活细胞门,再到CD45阳性的白细胞门,最后确定CD16阳性的中性粒细胞。
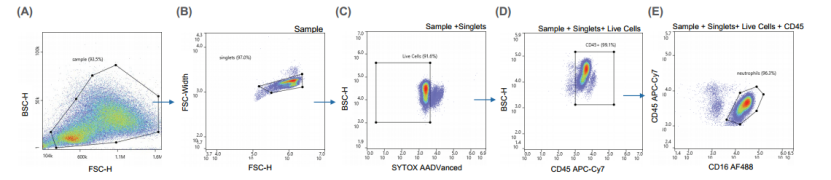
图1. 分选中性粒细胞的圈门策略:使用WOLF G2软件,用户可以轻松地对感兴趣的群体进行圈门以排序,(A)使用FSC/BSC散点图创建样本门并消除碎片。(B)通过FSC-width vs FSC-H图确定了单细胞门。(C)用活性染料从单细胞门鉴定活细胞,(D)白细胞鉴定为CD45+,(E)最后,中性粒细胞在CD45+ vs CD16+图中被鉴定为CD16+。
分选后的样本在37°C、5% CO2环境中孵育2小时,然后重新使用WOLF G2进行分析,评估存活率、纯度和中性粒细胞的激活状态。
1、WOLF G2分选后,纯度从92 ± 1.9% SD提高至98 ± 0.3% SD(图2),存活率从88 ± 1.6% SD提高至97 ± 0.1% SD(图3)。虽然从梯度富集的样品开始,但WOLF进一步去除了死亡的中性粒细胞,这些中性粒细胞可以继续释放细胞因子并增加样品中活化的中性粒细胞的数量[5]。
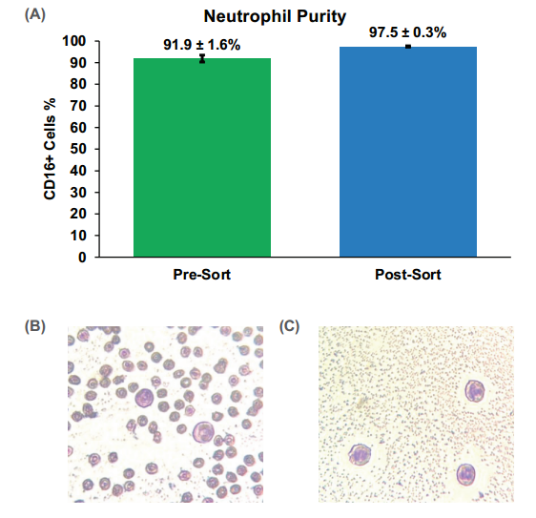
图2. 高纯度中性粒细胞的分选结果: 基于活CD16-AF488阳性细胞进行分选后,中性粒细胞的纯度提高了约6.0%。此外,用Wright染色的(B)全血和(C)分选后样本的代表性图像显示了细胞碎片和不需要的细胞的有效去除。使用明场(ECHO Revolve)以40倍放大率对载玻片进行成像。
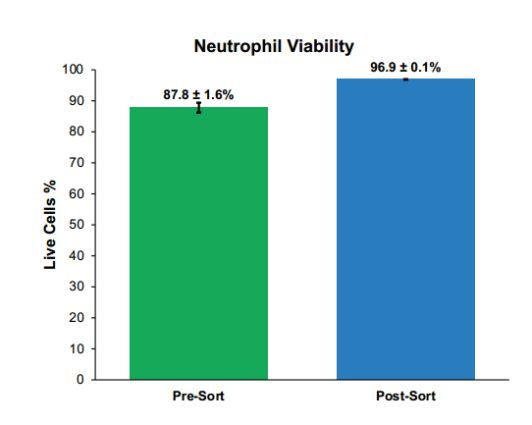
图3. 分选后中性粒细胞活力: 在增加活中性粒细胞数量的同时,重要的是,与SYTOX AADvanced阳性死亡细胞超过11%的预分选样品相比,分选后样品中的死亡细胞数量减少了3倍以上,约为2.9%
2、分选的中性粒细胞与未分选对照相比,未观察到激活中性粒细胞数量的变化,而激活对照组显示CD11b阳性的激活中性粒细胞数量显著增加(图4)。
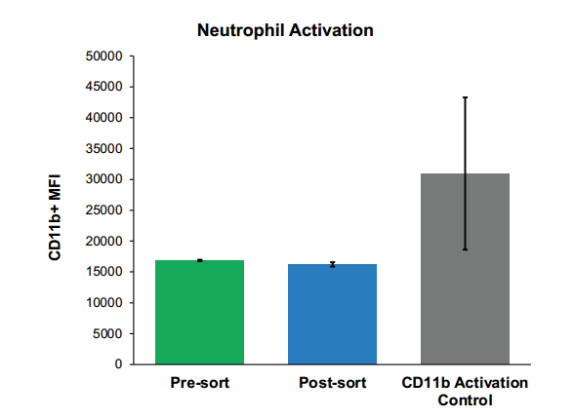
图4. 分选后无中性粒细胞活化:使用微流控分选可分离出分选后无活化的中性粒细胞。相比之下,活化对照样品与分选前和分选后的样品相比,活化细胞增加了两倍。
WOLF G2单细胞柔性分选系统为中性粒细胞的分离和研究提供了一种全新的方法,通过温和的分选过程,实现了高纯度和高存活率的目标,同时避免了细胞活化,为后续应用和新疗法的发现提供了有力支持。
同腾睿杰(上海)生物科技有限公司作为Nanocellect中国南区总代理商,为您提供优质的售前售后服务。
联系电话:021-50826962
联系邮箱:sales@ttbiotech.com
1. Karsten, C. B., Mehta, N., Shin, S. A., Diefenbach, T. J., Slein, M. D., Karpinski, W., Irvine, E. B., Broge, T., Suscovich, T. J., & Alter, G. (2019). A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods, 471, 46–56. https://doi.org/10.1016/j.jim.2019.05.006
2. Rosales, C. (2018). Neutrophil: A cell with many roles in inflammation or several cell types? Frontiers in Physiology, 9. https://doi.org/10.3389/ fphys.2018.00113
3. Blanter, M., Gouwy, M., & Struyf, S. (2021). Studying Neutrophil Function in vitro: Cell Models and Environmental Factors. Journal of Inflammation Research, Volume 14, 141–162. https://doi.org/10.2147/jir.s284941
4. Blanter M, Cambier S, De Bondt M, Vanbrabant L, Pörtner N, Abouelasrar Salama S, Metzemaekers M, Marques PE, Struyf S, Proost P & Gouwy M (2022) Method Matters: Effect of Purification Technology on Neutrophil Phenotype and Function. Front. Immunol. 13:820058. doi: 10.3389/fimmu.2022.820058
5. Iba, T., Hashiguchi, N., Nagaoka, I., Tabe, Y., & Murai, M. (2013). Neutrophil cell death in response to infection and its relation to coagulation. Journal of Intensive Care, 1(1). https://doi.org/10.1186/20




